miércoles, 3 de junio de 2015
Ligas de referencias
www.profesorenlinea.com.mx/Quimica/ReaccionQuimVelocidad.htm
www.quimicaweb.net/grupo_trabajo_fyq3/tema6/index6.htm
www.youtube.com/watch?v=PNpLw0HQjV8
www.textoscientificos.com/polimeros
www.monografias.com/trabajos11/polim/polim.shtml
www.comoves.unam.mx/articulos/jordan/jordan.html
Gráficas sobre los desechos en México
En México, el principal uso de los envases de PET lo llevan las botellas de refresco, con más del 50%, seguido del agua embotellada (17%).

Más de la mitad de basura que se genera en todo el país se recolecta en siete entidades.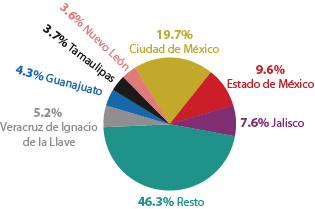
Más de la mitad de basura que se genera en todo el país se recolecta en siete entidades.

¿Cómo se debe manejar la basura plástica?
Toda legislación urge generar menos residuos amparados en un diseño ecológico nacional y global, para proteger el medio ambiente y al género humano. El Municipio debería recoger la basura en un sistema selectivo organizado, difundido; añadiendo un prototipo de contenedores y luego ejecutar el plan “Golfo de Guayaquil” de un proyecto que construya dos plantas: una de biometanización con un costo de $ 28 millones para tratar materia orgánica produciendo biogás, y un compost de alta calidad. La otra clasificadora de basura por $ 22 millones que separaría para luego recuperar tipos de residuos: papel, cartón; vidrio, envases..., y reducir la basura depositada.
¿La basura plástica es biodegradable? ¿Y cuáles son las desventajas?
Aunque las ventajas son muchas, al desechar al ambiente el envase porque es descartable, no sirve o se ha roto, el plástico es difícilmente biodegradable y hace que se convierta en gran desventaja. Preocupan sus volúmenes, su característica fundamental ¡nociva!, tarda de 25 a 500 años en descomponerse. En el mar es más lento todavía debido a temperaturas bajas y a la protección de la acción de los rayos ultravioletas del sol. Se calcula que la nube de residuos puede alcanzar entre 20 y 30 m de profundidad, y en algunas zonas la relación entre el peso del plancton y otros objetos flotantes es de 1 a 6. O sea por 1 kg de plancton hay 6 de desperdicios. El plástico como desecho provoca obstrucción de tuberías, estancamiento de aguas y trae enfermedades. Actúa silenciosamente contra la naturaleza, en el deterioro de la capa de ozono; interfiere en los componentes del ecosistema continental y marino y puede que en el propio funcionamiento del sistema. Su producción-consumo en crecimiento sin control genera el 30% de más volumen en la composición y generación de basura bruta proveniente del sector rural, cantonal, y la masa de residuos sólidos urbana no está acorde con la tecnología de aprovechamiento en recogida, reciclaje y reutilización.
Basura plástica
Introducción
Los plásticos son sintéticos, altamente inflamables, de origen orgánico, logrados en laboratorio; se obtienen artificialmente a partir de productos del petróleo, carbón, etcétera. En alguna fase de fabricación han adquirido suficiente plasticidad, flexibilidad, dureza y color. Por su propiedad es más liviano que los metales y fácil de amoldar, y como descubrimiento se lo atribuye a Leo Hendrik allá por 1864 en Estados Unidos; y ha derivado en objetos para la industria de alimentos, automotriz, juguetes, etcétera, con su masiva comercialización.
Los plásticos son sintéticos, altamente inflamables, de origen orgánico, logrados en laboratorio; se obtienen artificialmente a partir de productos del petróleo, carbón, etcétera. En alguna fase de fabricación han adquirido suficiente plasticidad, flexibilidad, dureza y color. Por su propiedad es más liviano que los metales y fácil de amoldar, y como descubrimiento se lo atribuye a Leo Hendrik allá por 1864 en Estados Unidos; y ha derivado en objetos para la industria de alimentos, automotriz, juguetes, etcétera, con su masiva comercialización.
Acrónimos de los plásticos principales
ABS ACRILONITRILO-BUTADIENO-ESTIRENO: Utilizado en
automoción y otros usos tanto industriales como domésticos. Es un termoplástico
amorfo.





CA ACETATO DE CELULOSA:Es usado como fibra textil y en la
fabricación de filtros de cigarrillos, barajas, barniz, entre otros.
EP EPOXICA: Se utiliza principalmente para la elaboración de
pinturas.
EPS POLIESTIRENO EXPANSIBLE: Se utiliza para hacer envases
diversos y para la construcción.
EVA ETIL VINIL ACETATO: Se utiliza para un tipo de papel
espumoso (fomi).
HDPE POLIETILENO ALTA DENSIDAD: Principalmente se utiliza
para la elaboración de envases desechables.
LDPE POLIETILENO BAJA DENSIDAD: Se utiliza principalmente
para la elaboración de envases reciclables.
MF MELAMINA FORMALDEHIDO: Es un soluble en el agua y se
utiliza en la construcción
Polímeros, Plástico, Caucho, Neopreno, Hule
Definición de Conceptos con sus distintivos
1.Los polímeros son macromoléculas(generalmente orgánicas) formadas por la unión de moléculas más pequeñas llamadas monómeros.
2.El término plástico, se aplica a las sustancias de similares estructuras que carecen de un punto fijo de evaporación y poseen, durante un intervalo de temperaturas, propiedades de elasticidad y flexibilidad que permiten moldearlas y adaptarlas a diferentes formas y aplicaciones.
3. El caucho es un polímero elástico, cis-1,4-polisopreno, polímero del isopreno o 2-metilbutadieno. C5H8 que surge como una emulsión lechosa (conocida como látex) en la savia de varias plantas, pero que también puede ser producido sintéticamente.
4. Neopreno es la marca comercial para una familia de cauchos sintéticos basadas en el policloropreno.
5. El hule es un polímero natural o sintético, en el primer caso hecho de la savia de plantas específicas, como por ejemplo la Castilla elástica.
1.Los polímeros son macromoléculas(generalmente orgánicas) formadas por la unión de moléculas más pequeñas llamadas monómeros.
2.El término plástico, se aplica a las sustancias de similares estructuras que carecen de un punto fijo de evaporación y poseen, durante un intervalo de temperaturas, propiedades de elasticidad y flexibilidad que permiten moldearlas y adaptarlas a diferentes formas y aplicaciones.
3. El caucho es un polímero elástico, cis-1,4-polisopreno, polímero del isopreno o 2-metilbutadieno. C5H8 que surge como una emulsión lechosa (conocida como látex) en la savia de varias plantas, pero que también puede ser producido sintéticamente.
4. Neopreno es la marca comercial para una familia de cauchos sintéticos basadas en el policloropreno.
5. El hule es un polímero natural o sintético, en el primer caso hecho de la savia de plantas específicas, como por ejemplo la Castilla elástica.
Tipo y clasificación de los extintores
Los extintores son elementos portátiles destinados a la lucha contra fuegos incipientes, o principios de incendios, los cuales pueden ser dominados y extinguidos en forma breve.
De acuerdo al agente extintor los extintores se dividen en los siguientes tipos:
- A base de agua
- A base de espuma
- A base de dióxido de carbono
- A base de polvos
- A base de compuestos halogenados
- A base de compuestos reemplazantes de los halógenos
Listaremos a continuación los extintores mas comunes, y los clasificaremos según la clase de fuego para los cuales resultan aptos:
Extintores de agua
El agua es un agente físico que actua principalmente por enfriamiento, por el gran poder de absorción de calor que posee, y secundariamente actua por sofocación, pues el agua que se evapora a las elevadas temperaturas de la combustión, expande su volumen en aproximadamente 1671 veces, desplazando el oxígeno y los vapores de la combustión. Son aptos para fuegos de la clase A. No deben usarse bajo ninguna circunstancia en fuegos de la clase C, pues el agua corriente con el cual estan cargados estos extintores conduce la electricidad.
Extintores de espuma (AFFF)
Actúan por enfriamiento y por sofocación, pues la espuma genera una capa continua de material acuoso que desplaza el aire, enfría e impide el escape de vapor con la finalidad de detener o prevenir la combustión. Si bien hay distintos tipos de espumas, los extintores mas usuales utilizan AFFF, que es apta para hidrocarburos. Estos extintores son aptos para fuegos de la clase A y fuegos de la clase B.
Extintores de dióxido de carbono
Debido a que este gas esta encerrado a presión dentro del extintor, cuando es descargado se expande abruptamente. Como consecuencia de esto, la temperatura del agente desciende drasticamente, hasta valores que estan alrededor de los -79°C, lo que motiva que se convierta en hielo seco, de ahí el nombre que recibe esta descarga de "niebe carbónica". Esta niebla al entrar en contacto con el combustible lo enfría. También hay un efecto secundario de sofocación por desplazamiento del oxígeno. Se lo utiliza en fuegos de la clase B y de la clase C, por no ser conductor de la electricidad. En fuegos de la clase A, se lo puede utilizar si se lo complementa con un extintor de agua, pues por si mismo no consigue extinguir el fuego de arraigo. En los líquidos combustibles hay que tener cuidado en su aplicación, a los efectos de evitar salpicaduras.
Extintores de Polvo químico seco triclase ABC
Actúan principalmente químicamente interrumpiendo la reacción en cadena. También actúan por sofocación, pues el fosfato monoamónico del que generalmente estan compuestos, se funde a las temperaturas de la combustión, originando una sustancia pegajoza que se adhiere a la superficie de los sólidos, creando una
barrera entre estos y el oxígeno. Son aptos para fuegos de la clase A, B y C.
Extintores a base de reemplazantes de los halógenos (Haloclean y Halotron I)
Actúan principalmente, al igual que el polvo químico, interrumpiendo químicamente la reacción en cadena. Tienen la ventaja de ser agentes limpios, es decir, no dejan vestigios ni residuos, además de no ser conductores de la electricidad. Son aptos para fuegos de la clase A, B y C.
Extintores a base de polvos especiales para la clase D
Algunos metáles reaccionan con violencia si se les aplica el agente extintor equivocado. Existe una gran variedad de formulaciones para combatir los incendios de metales combustibles o aleaciones metálicas. No hay ningún agente extintor universal para los metales combustibles, cada compuesto de polvo seco es efectivo sobre ciertos metales y aleaciones especificas. Actúan en general por sofocación, generando al aplicarse una costra que hace las veces de barrera entre el metal y el aire. Algunos también absorven calor, actuando por lo tanto por enfriamiento al mismo tiempo que por sofocación. Son solamente aptos para los fuegos de la clase D.
Extintores a base de agua pulverizada
La principal diferencia como los extintores de agua comunes, es que poseen una boquilla de descarga especial, que produce la descarga del agua en finas gotas (niebla), y que además poseen agua destilada. Todo esto, los hace aptos para los fuegos de la clase C, ya que esta descarga no conduce la electricidad. Además tienen mayor efectividad que los extintores de agua comunes, por la vaporización de las finas gotas sobre la superficie del combustible, que generan una mayor absorción de calor y un efecto de sofocación
mayor (recordar que el agua al vaporizarse se expande en aproximadamente 1671 veces, desplazando oxígeno). Son aptos para fuegos de la clase A y C.
Extintores para fuegos de la clase K a base de acetato de potasio
Son utilizados en fuegos que se producen sobre aceites y grasas productos de freidoras industriales, cocinas, etc. El acetato de potasio se descarga en forma de una fina niebla, que al entrar en contacto con la superficie del aceite o grasa, reacciona con este produciendose un efecto de saponificación, que no es mas que la formación de una espuma jabonosa que sella la superficie separandola del aire. También esta niebla tiene un efecto refrigerante del aceite o grasa, pues parte de estas finas gotas se vaporizan haciendo que descienda la temperatura del aceite o grasa.
Triángulo de fuego
El triángulo de fuego o triángulo de combustión es un modelo que describe los tres elementos necesarios para generar la mayor parte de los fuegos: un combustible, un comburente (un agente oxidante como el oxígeno) y energía de activación. Cuando estos factores se combinan en la proporción adecuada, el fuego se desencadena. Por otra parte, es igualmente posible prevenir o atacar un fuego eliminando uno de ellos:
Sin el calor suficiente, el fuego no puede ni comenzar ni propagarse. Puede eliminarse introduciendo un compuesto que tome una parte del calor disponible para la reacción. Habitualmente se emplea agua, que toma la energía para pasar a estado gaseoso. También son efectivos polvos o gases con la misma función.
Sin el combustible el fuego se detiene. Puede eliminarse naturalmente, consumido por las llamas, o artificialmente, mediante procesos químicos y físicos que impiden al fuego acceder al combustible. Este aspecto es muy importante en la extinción de incendios (por ejemplo, mediante cortafuegos, así como en los incendios controlados.
La insuficiencia de oxígeno impide al fuego comenzar y propagarse.
Premio nobel de la química a un mexicano
Clasificacion de las reacciones químicas por la velocidad de generación
En algunos casos el cambio de reactivo a producto se verifica con lentitud. Así ocurre con un clavo (de hierro) que expuesto a la intemperie (con el oxígeno del aire), necesita de cierto tiempo (horas, días, meses) para que se observe la formación de óxido.
Sin embargo, hay reacciones que se realizan muy velozmente, como la de magnesio (trozo de cinta) que al agregarle unas gotas de ácido clorhídrico concentrado reacciona rápidamente transformándose en cloruro de magnesio con desprendimiento de hidrógeno y calor (en una reacción exotérmica)
La velocidad con que reaccionan las sustancias dependerá de que los choques entre partículas (átomos, iones o moléculas) sean efectivos; esto es, deben tener la energía necesaria para reaccionar.
Sin embargo, hay reacciones que se realizan muy velozmente, como la de magnesio (trozo de cinta) que al agregarle unas gotas de ácido clorhídrico concentrado reacciona rápidamente transformándose en cloruro de magnesio con desprendimiento de hidrógeno y calor (en una reacción exotérmica)
La velocidad con que reaccionan las sustancias dependerá de que los choques entre partículas (átomos, iones o moléculas) sean efectivos; esto es, deben tener la energía necesaria para reaccionar.
Factores que afectan la velocidad de una reacción
La velocidad de reacción se calcula midiendo la rapidez de aparición de un producto o la desaparición de un reactivo.La velocidad de una reacción se ve influida por una serie de factores; entre ellos se pueden destacar:

Naturaleza de los reactivos
Se ha observado que según los reactivos que intervengan, las reacciones tienen distinta velocidad, pero no se ha podido establecer aún unas reglas generales.
Concentración de los reactivos
La velocidad de reacción aumenta con la concentración de los reactivos. Para aumentar la concentración de un reactivo:
- Si es un gas, se consigue elevando su presión.
- Si se encuentra en disolución, se consigue cambiando la relación entre el soluto y el disolvente.
Superficie de contacto de los reactivos
Cuanto más divididos están los reactivos, más rápida es la reacción. Esto es así porque se aumenta la superficie expuesta a la misma.
Temperatura
En general, la velocidad de una reacción química aumenta conforme se eleva la temperatura.
Presencia de catalizadores
Un catalizador es una sustancia, distinta a los reactivos o los productos, que modifican la velocidad de una reacción. Al final de la misma, el catalizador se recupera por completo e inalterado. En general, hace falta muy poca cantidad de catalizador.
Los catalizadores aumentan la velocidad de la reacción, pero no la cantidad de producto que se forma.
Las vitaminas, fermentos, levaduras, hormonas y enzimas son catalizadores biológicos. Su presencia en los seres vivos hace posible efectuar reacciones químicas que desarrolladas en el laboratorio resultarían extremadamente lentas.
Las vitaminas, fermentos, levaduras, hormonas y enzimas son catalizadores biológicos. Su presencia en los seres vivos hace posible efectuar reacciones químicas que desarrolladas en el laboratorio resultarían extremadamente lentas.
Suscribirse a:
Comentarios (Atom)